2023年07⽉19⽇
中部大学応用生物学部客員教授 日本医療研究開発機構CREST-PRIME脂質領域研究総括 横山信治

1. プロローグ
2020年に始まるコロナパンデミックとそれに続くあるいはそれに引き金を引かれたかも知れないウクライナ戦争に翻弄される現在は、後世世界史に語り伝えられる重要な動乱の時代の幕開けとなるのかも知れません。今年喜寿を迎えてしまった私の世代はこの動乱の後の次の世界の「定常状態」を見ることはないのかも知れません。思い返せば、第二次世界大戦の終結前後に生を受け、その後の日本を巡る「相対的平和」の時代を日本人として生きてきた私たちの世代は、人類史上まれに見る幸福なグループであったのかも知れません。私たちが「三振振り逃げ」をした後に残される日本の若い世代はもっと色々な困難に直面せざるを得ないであろうことに、申し訳ない気持ちでいっぱいです。
1968年をピークとした時代は、そういう私たちが経験した数少ない動乱の季節でした。大戦終結から20年余を経て世界が少し動き始めた時、ベトナム戦争が世界情勢のキーワードであった時代です。東京大学の「大紛争」の震源地である医学部の学生であった我々が経験した大混乱はなかなか一言では語り尽くせません。そして、後々に、世界の様々な場所でこの時代を過ごした多くの同世代の友人を得るにつれ、我々も世界史の一部であったのかとつくづくの感慨を持つ事になります。曰く、ベトナムに従軍して解放戦線のテト攻勢と闘ったアメリカ人ポスドク、徴兵のがれでアメリカからカナダに移住してそのままカナダ人になった研究者、オハイオ州立大学の反戦デモへの州兵の発砲を涙を流しながら繰り返し語ったシカゴ大学のgraduate student、プラハの医学生としてソ連の戦車に石を投げていた後のカナダの医学部教授、カルチェラタンでバリケードを造っていたフランス人研究者、文化大革命の下放でタバコ畑の重労働をしていた中国人研究者、極めつけは義勇兵としてベトナム戦争でアメリカ軍と闘い、その後カメラマンとしてカナダに流れ着いていたキューバ人など、挙げて行けばきりがありません。
ともかくそのような時を経て私たちが卒業したのは1972年、東京大学医学部は「大紛争」後の瓦礫の中でした。人生の選択肢をまだなにも決められないままとりあえず大学病院の内科「研修医」となり、結局そのままズルズルと中途半端なアカデミズムの道に迷い込んでしまいました。
脂質を研究のテーマとして選んだのは何故か。まわりの秀才たちが寄って来なさそうだから、というのが多分正直なところでした。日本では臨床家にとってはまだ未成熟な分野で、動脈硬化症の病因論という漠然としてテーマには手がかりもなく、競争にもならず、ぼんやりしていても当分は大丈夫かな、と。
もうひとつ、脂質のことが「気がかり」だったキーワードがありました。「自然の弁証法(dialectics of nature)」、Friedrich Engelsの著作、というより、彼が自然科学に関して書き散らかした原稿を寄せ集めた冊子です。十九世紀後半の自然科学の知見を彼らの「弁証法」で解釈しようというもので、そのおそろしい博学ぶり、自然科学的知識の深さに驚くばかりです。Leninの死去直後の混乱の中で1925年にソ連で出版されたもので、おそらくLeninの時代に編集されたものです。今読むと、彼Engelsのキリスト教的中世の反科学性への怨念のようなものが湧き出ていて、その分、かなり無理をして「自然界の法則も弁証法だ!」と叫んでいるような内容です。ここに「量から質への転換」と云う命題の実例として炭化水素の分子が登場するのです。曰く、炭素数の増加により分子の性質は劇的に変化して行く、と。生命科学を学ぶ学生としてこれを読んだ時、はてこんな例を挙げて良いのだろうかという疑問がわきました。
その頃、既にコンピュータによるデータ解析は一般化されつつ有り、大量のデータの処理が「質的に」異なる次元の情報に転換する、という未来は見え始めていました。CT撮影の実用化は目前の頃です。これこそが「量の質への転化」、「対立矛盾の止揚」とならぶ弁証法的認識論の基本ではないか、と。で、なぜEngelsはこんな例を挙げたのか、多分、MarxとEngelsの良き友で当時炭化水素の構造のトップ研究者であったイギリス王立科学院のメンバーのドイツ人有機化学者Carl Schorlemmer のアドバイスだったんだろう、ということは今は想像できます。兎も角、この件がずっとアタマに引っかかっていて、なんとなく脂質の怨念に引きずられていったような気もします。
2. コレステロール、不思議で厄介な生体物質
血漿中のコレステロールが増えると動脈硬化になる、という漠然として臨床の概念は1950年代から確立し始めており、アイゼンハワーが心筋梗塞になったことがアメリカでこの研究を加速させた、という噂が信じられています。臨床的に脂質の研究に入って行くということは必然的にコレステロール代謝がその対象になってゆくことになりました。しかし、1970年代の始め、この物質について分かっていることはかなり限られたことでした。後に述べるように、ちょうどこの頃コレステロール代謝の研究におけるパラダイムシフトが起こりつつあったのですが、そんなこととはつゆ知らず、手探りで勉強を始めておりました。
コレステロールの存在自体は、胆石中から分離されることで18世紀末には知られていましたが、六炭素環状構造3つと五炭素環状構造1つからなる「ステロイド」骨格を持ち側鎖と水酸基により高級アルコールとしての性質を持つ分子構造が知られたのは20世紀の前半です。その生合成の研究によりスクアレンのエポキシ化により一気に造られるその「ステロイド」骨格の立体的構造が明らかになったのは、実に1966年になってからです。この水に難溶な生体物質は、その物性や存在様式、代謝の性質からは脂質に分類されても、脂肪酸鎖(アルキル鎖)の存在で定義される殆どの脂質分子とは異なり、「ステロイド」骨格の構造は平面的で柔軟性を欠き、いったん形成されると極めて分解されにくい性質を持ちます。この分子の代謝の最大の特徴(あるいは問題点)はこのステロイド骨格が合成も分解も困難であるという点に尽きます。こうした視点からコレステロール代謝を眺めてみると、その独特の世界が浮き上がってきます。
動物の体細胞は、部分的な側鎖の酸化や水酸化などを除き、コレステロールの異化を殆ど行うことができません。体内のコレステロールは異化のためにほぼすべてが肝臓に運ばれ、ここで大半の分子は、側鎖のカルボン酸化とステロイド核の水酸化により胆汁酸に転換されて、胆汁中に排泄されことはよくご存じのことです。胆汁酸はステロイド骨格を基本にした界面活性化合物であり、消化管内で食餌性脂質をミセル化して消化酵素(リパーゼ)の水解反応の効率を高めその消化吸収を介助します。胆汁酸は脊椎動物では所謂「腸肝循環」により腸管からの再吸収と肝臓からの再分泌による再利用を繰り返しながら、最終的には糞便中に排出さます。一方、コレステロールのかなりの部分は肝臓から胆汁中にそのまま排泄され、これも再吸収再分泌の循環を経て糞便中に排泄されます。
一方、ごく一部のコレステロールはステロイド産生細胞で側鎖が切断されステロイドホルモンに転換さますが、これらもステロイド骨格はそのままで不活性化され、胆汁中や尿中に排泄されます。このように、ステロイド化合物の骨格は動物体内で分解されることはなく、最終的には土壌中などの細菌によって異化が行われます。つまり、ステロールの代謝は環境・生態系を含めてはじめて成立するのです。野生動物が自然の中で暮らしているうちはそれで良いのですが、人類が大集団で密集して暮らすようになると、都市に於ける下水処理に大きな環境問題が生じます。尿中に排泄されるステロイドの「環境ホルモン」化です。下水処理におけるステロイド分解活性の高いバクテリアの役割は非常に重要なものなのです。
こうした代謝困難な環状構造という面から共通の性質を持つのがヘムやプリン核で、これらも、ビリルビンや尿酸という環状構造を含む化合物のかたちで体外に排泄され、あとはバクテリア任せという代謝システムになります。ステロール分子代謝の唯一の例外はビタミンDの生成で、コレステロールからステロイド骨格をもつ前駆体が形成されこれが紫外線により分解されてビタミンDが生成されます。内在性代謝システムによるものではないとはいえ、体内でステロイド骨格が分解される例外的なものといえるでしょう。
動物におけるコレステロールの代謝は、生合成と外部からの食餌性の調達を収入源とした全身への分配システムと、末梢細胞から肝への回収と胆汁酸への転換、その排泄を中心とした異化排泄システムからなります。既述の如くステロイド骨格の分解には体外のバクテリアの助けを借りねばならず、コレステロール分子からのエネルギー産生は、ステロイドホルモン合成のために切断される側鎖の炭化水素から僅かにあり得るのみで、全体としては殆ど無視できます。ヒト体内には100〜150 gのコレステロールが存在し(その25 % 以上は中枢神経系に存在)、代謝回転は一日 1 g 程度で、異化率は0.007-0.01/dayとゆっくりしています。食餌性摂取は日本人では一日 300 mg 以下で欧米でも一日 500 mg を超えることはまれであり、残りの需要は生合成で埋められます。異化は肝臓での胆汁酸への転換が一日 500 mg、残りはコレステロールとしてそのまま排泄されるとみるべきです。胆汁酸の肝臓から胆汁中への排泄量は一日20〜30g、コレステロールのそれも2〜3gにものぼるが、その多くは再吸収・腸肝循環によるもので、ネットの体外への排泄はそれぞれ 500 mg 程度で、供給との収支が合うとされます。ステロイドホルモンとしての排泄は量的には殆ど無視できます。
機能的コレステロールはほぼすべての細胞膜に存在します。主として形質膜の外側(outer leaflet)に偏在してその機能制御に重要な役割を果たします。物理化学的には、ステロールはグリセロ燐脂質の二重膜に均一に混合され、一般的には柔軟性の乏しいステロール分子の含有量が増えると膜脂質の流動性は低下することから、これによって膜の流動性・柔軟性を制御しうると考えられます。しかし、細胞生物学的に最も重要な機能は、スフィンゴ燐脂質(主にスフィンゴミエリン)との相互作用です。
スフィンゴリン脂質も膜内でグリセロリン脂質と均一に混合されるが、これとコレステロールが同時に存在すると両者は高い親和性で相互作用しクラスターを形成します。ご存じ「ラフト」です。グリセロ燐脂質を主とした生体膜において周りとは異なる物理化学的に安定で流動性が低いミクロ環境を形成し、グリセロ燐脂質の海を漂う筏になぞらえてそう呼ばれます。この構造の存在により、膜蛋白質の脂質との相互作用の物理化学的特徴によって膜内におけるその二次元分布が制御され、この環境を「好む」特定膜蛋白質をここに集積させて「装置」を組み立てることができます。代表的なものは膜内外を結ぶシグナル伝達機能であり、この機能は多細胞生物においてより基本的な細胞機能であって、多くの単細胞生物がステロールなしに生活できることからも、ステロール機能に関するこうした見方が支持されることになります。
ステロイド骨格の生合成は37段階にも数えられる複雑なステップと最低ATPが3分子、NADPHが7分子を要する複雑な過程です。出発点は「代謝の交差点」であるacetyl-CoA であり、脂質合成の普遍的な出発点であって、糖、脂質、蛋白質の代謝のどこからでもコレステロール生合成の入り口に辿り着けます。コレステロール生合成の初期の重要なポイントは、acetyl-CoA 三分子からのhydroxymethylglutaryl-CoA(HMG-CoA)の合成と、HMG-CoA 還元酵素によるメバロン酸の生成で、これはコレステロール合成の最初で最大の律速段階で、この酵素の制御の解明がコレステロール代謝研究の最大の成果であり臨床的価値をもつものとなったことは後述します。
メバロン酸は枝分かれ炭素鎖のアシル酸であるイソプレニル基に合成され、イソプレニル化合物の最終段階であるスクアレンがSqualene epoxidase によりエポキシ化されて、枝分かれ炭化水素鎖化合物を複雑に環状化するステロイド骨格の合成が一気におこなわれるます。しかし、コレステロールにたどり着くにはさらに多くの反応を必要とします。コレステロールの合成は有機化学的に行うことも可能ではありますが、複雑かつ低効率であり、現在に至るも工業的合成は行われていません。コレステロールの産業的利用は、ステロイドホルモン剤の合成や有機液晶パネルなど広く行われていますが、全ては自然界の生物資源の利用によっていることも、この分子の生成分解の特殊な有り様を示しています。
3. コレステロールへの「臨床的」スポットライトと脂質研究のパラダイムシフト
高等生物におけるステロール代謝は、とりわけ動物においては、面倒な生合成の手間を省くための食餌性摂取への依存と異化の手間を体外のバクテリアに外注する「省エネ」代謝システムのため、細胞間・組織間・臓器間の輸送システムの関与がないと成立しません。
コレステロールを始めとする脂質の細胞外輸送は、蛋白質によって生物学的標識を与えられた脂質ミクロエマルジョンである「所謂」リポ蛋白質という分子集合体によって担われます。このシステムの詳細は複雑で、種によって特異的な形態をとります。脊椎動物では、大まかに云って、次のようになります。食餌性コレステロールは血流を介してまず肝臓に集積され、そこで生合成された分子とともに末梢組織へ向けて超低密度リポ蛋白質very low density lipoprotein (VLDL) – 低密度リポ蛋白質 low density lipoprotein (LDL) 系により輸送されます。末梢組織では異化できないコレステロール分子は、殆どすべてが 高密度リポタンパクし high density lipoprotein (HDL)によって回収され、肝臓に運ばれ、胆汁酸への転換などにより体外へ排出されます。しかし血中では、これらの粒子間では非特異的なステロール分子の交換もおこり、ヒトなどではエステル化されたコレステロール分子がHDL系からVLDL/LDL系に乗り換えて肝臓へ向かう経路も存在するなど、複雑多岐にわたり、その結果コレステロールの細胞外輸送の方向性と量は全体としては動態平衡(dynamic kinetics)的に制御されています。
コレステロール代謝平衡は全体としてはエネルギー代謝からは相対的に独立しており、総体としてはステロール分子による産生物フィードバックにより制御されています。しかし、それぞれの代謝因子の遺伝子発現を調節しているのは一連のステロール関連転写制御因子・核内受容体群で、これらは SREBP群、PPAR群、LXR/RXR/FXR 群などに属し、何れももとを質せばエネルギー代謝関連遺伝子群の制御にかかわる転写制御因子です。つまり、おそらくはその一部がステロール代謝に特異的に関わるように進化を遂げたと考えらます。
従って、現在ではエネルギー代謝とは関わらなくなったステロール代謝といえども、基本的にはエネルギー代謝の制御系から派生し進化してきたと考えるのが妥当ではないかと考えられます。ステロールは、その起源や物理化学的性質から「脂質」とされ、その代謝制御に関わる遺伝子の転写制御因子群からも、脂質から派生した分子であることは疑いがありません。しかし、物性・代謝の面からは、現在では独自の生体物質としての側面を理解しておかないといけないでしょう。動物にとってコレステロール分子は生命維持の基本物質のひとつであり、その不足に対する危機管理体制は整っています。しかしその過剰への対策はこれまでの遺伝子の進化のなかでは考慮されていない「想定外」の状況である。ヒトの生活環境の変化による食餌性コレステロールの過剰摂取は、我々の栄養学的危機管理システムで対応が困難であり、動脈硬化症などを始めとする異化が出来ないコレステロールの異所性の蓄積を招くこととなります。
1970年代半ば、ステロール代謝の研究から脂質研究に於けるパラダイムシフトが起こります。血漿中コレステロールの濃度が増加することと動脈硬化症、とりわけ心筋梗塞などの「冠状動脈疾患」発症の危険性が増す、ということは20世紀後半には知られるようになり、この疾患が最大の死因でるいわゆる「欧米」では医学研究の最も重要な課題となってきました。その結果、血漿中の脂質は先に述べたように「リポタンパク質」として存在することが分かり、臨床的危険性はLDL中のコレステロールの増加によることが解明されます。
そういう中で、遺伝的にLDL上昇が起こり若年性冠状動脈疾患を引き起こす家族性高コレステロール血症(familial hypercholesterolemia; FH)をアメリカのダラスで研究していたMichael BrownとJoseph Goldsteinが脂質研究にパラダイムシフトを起こす重要な研究成果を挙げます。「LDL受容体」の発見です。1973〜74年にかけ、彼らは、ヒトの皮膚繊維芽細胞のコレステロール合成は培地中のLDLの存在で抑制されるが、FHホモ接合体患者の繊維芽細胞ではこれが起こらず、またこれはLDL粒子がFH細胞には結合できないためであることを見いだします。ここから数年の間に、彼らはこの反応を担う膜タンパク質LDL受容体として同定、その遺伝子の発現制御の基本機構を明らかにしました。これはいくつかの意味で脂質研究のみならず細胞生物学の上にもパラダイムシフトを起こします。
まず第一に、これにより脂質研究のメインストリームが生化学的研究から細胞生物学・分子生物学的研究にシフトして行きます。第二に、「受容体」の概念に革命的変化が起こります。それまで薬理学的概念で捉えられていた「受容体」が、代謝制御システムも含む広い概念に拡大しました。「LDL受容体」という命名に対して、最初は少なからぬ研究者が違和感を持ったものです。第三に、動脈硬化症の予防・治療研究に、具体的分子標的の概念が与えられたことです。血漿LDL濃度の低下はLDL受容体の発現増加により達成できる、ということが臨床的に証明されることになったのです。
このいわば脂質研究に於ける革命的研究成果には、偶然同じタイミングでなされた日本人の研究が大きく関与したことは、ご存じの方もあるかと思います。神戸大学の渡辺義雄教授によるFHのモデル(LDL受容体欠損)動物であるWHHL rabbit の確立(1975年〜)と、三共のの遠藤章研究員(後に東京農工大教授)によるコレステロール合成の律速酵素であるHMG-CoA reductase の阻害剤(スタチン)の発見(1976年)です。この日本発の二つの要素が Brown & Goldstein の研究に多大な促進因子となり、LDL受容体の活性の持つ臨床的意義が明らかになって行きます。そして、すでに臨床的に用いられていた胆汁酸吸着レジンが胆汁酸の腸肝循環を断ち切ることで肝細胞に於けるコレステロールの胆汁酸への転換を促進して肝細胞のLDL受容体活性を上げること、スタチンによるコレステロール合成の阻害も同様の効果をもたらすこと、が明らかになります。1984年、胆汁酸吸着レジンによるLDL低下が冠状動脈硬化疾患の発症を予防できることが体規模臨床試験で示されるに至り、事態は一気に進みます。BrownとGoldstein は1985年にノーベル賞を受賞することになるのです。そして、1980年代後半にはスタチンの臨床開発が成功、その後の様々な大規模臨床試験により、現在に至る「LDL低下による動脈硬化予防」の基本戦略が確立するのです。
4. スタチンとの出会い
1979年、私はシカゴ大学生化学のポスドク三年目、そろそろ身の振り方を考えねばならない日々を過ごしておりました。アポリポタンパク質を模した生理活性ペプチドの研究プロジェクトに埋没し、共同研究先の有機化学のラボの担当ポスドクが、後に小野薬品の社長・会長、小野医学研究財団の理事長を歴任される福島大吉さんでした。どちらも日本にも職はなく、明日をも知れぬ非正規労働者として、どこかいい就職口はないか、とぼやきながら毎日一緒に実験をしておりました。私たちの研究は脂質タンパク質複合体エマルジョンである血漿リポタンパク質がどのように生物学的活性を獲得するのか、という生物物物理化学的テーマを追いかけておりました。LDL受容体の発見が脂質研究分野のパラダイムシフトとなるという歴史的認識は、アメリカの研究者の間でもまだ共有されていない頃です。
そういう日々のある時、大阪市の工業研究所というところから来られていた方とお話をしていて、大阪に国立循環器病センターという施設が出来た、という話題が出ました。そういうところで拾ってくれないかなあという雑談紛れの話が、回り回って、当時循環器病センター研究所に病因部長として大阪大学医学部から赴任されたばかりの山本章先生に伝言ゲームのように伝わり、それがまた伝言ゲームで私のところに戻ってきました。Eメールもスマホもない時代です。その年の11月にヒューストンで国際動脈硬化学会というものがあり、それに出席するから、そこで会えないか、というお話です。ダメ元でともかく行ってみようかと福島さんにも相談し、彼もそういう学会を見てみようと云って、二人でヒューストンに行くことになりました。
だだっ広い敷地にそびえる今は取り壊されてしまったヒルトンホテルが会場でした。何の予備知識も無く、山本章先生を探そうとプログラムを見ると、彼の名前が出ているセッションがあります。タイトルはML236Bの臨床使用経験とか云うようなもので、抄録には何も載っておらず、全くのノーマークの演題としか思えず、私にとってはそもそもML236Bって何?、というものでした(ML236Bは compactin に対する三共のコードネーム)。ともかくそこへと、福島さんと会場に行くと、さして大きな部屋ではなく、三〜四十人の聴衆がいて、私が座った前の席には、後に知遇を得ることになる遠藤章先生がおられました。山本先生のお話が始まりました。後年すっかり有名になったFHホモ患者に対するcompactin の使用経験です。今にして思えば、LDL受容体がない患者はスタチン投与の適応になる治療ではなかったのですが、それでもcompactin の「大量投与」では血漿コレステロールが下がり、皮膚黄色腫の退縮が明らかでした。それまでだらだらしていた会場の雰囲気が急に変わり、緊張感が漂い始めたのは明らかでした。
15分ほどの講演が終わると、会場のあちこちから手が挙がり、それはどこで何時手に入るのか、治験はどうなっているのか、といった質問が次々に発せられる事態となり、山本先生もどう答えるか思案されている様子が見て取れました。その時、会場の前の方で立ち上がったのが、日本の臨床家としての脂質代謝研究のパイオニアであり大御所であった東海大学の五島雄一郎先生です。
彼は、これは日本で発明された薬であり、今治験を始めたところである、希望があれば、アメリカやヨーロッパも巻き込んだ国際プロジェクトとして開発したい、という大演説をされたのです。それで会場は静まり、混乱はおさまりました。後で考えれば、五島先生の大いなる「はったり」であったわけです。これが、それまではLDL受容体研究の道具としてBrown & Goldstein のラボに実験用に提供されていたcompactin の、臨床経験についての公共の場での国際デビューでした。私は今もこの時の学会の分厚い抄録集を保存していますが、その中にはスタチンのスの字も出てきません。薬剤に関する抄録はフィブレートと胆汁酸吸着レジンぐらいです。LDL受容体発見の5年後、レジンによるLDL低下の虚血性心疾患一予防効果の証明の発表(Lipid Research Clinic-Coronary Primary Prevention Trial: LRC-CPPT)の5年前、Brown & Goldstein のノーベル賞受賞の6年前のことです。
ともかく、セッションの後、私は山本先生にご挨拶をし、二人でマクドナルドでハンバーガーを食べながら「面接」を受け、翌年大阪に帰国することになりました。福島さんも、同じ頃小野薬品に就職口が見つかり、殆ど同時に大阪に赴任することにって、その後も長い付き合いが続くことになります。学会が終わってから、二人でレンタカーを借りてジョンソン宇宙センターやガルベストンなどへ遊びに行きました。福島さんには、最近も私が研究総括をつとめたAMED CREST/PRIME の脂質領域でもアドバイザリーボードメンバーとしてお世話になりました。
1980年の夏、国立循環器病センター研究所の研究員として大阪での生活が始まりました。5階建の研究所は前年にできたばかり、山本章先生はランニングにステテコで出迎えて下さいました。何にもないがらんどうの部屋を「あんたの部屋」とあてがわれ、部屋の窓は開けっ放し、なんとエアコンがなかったのです。「予算が足らんかったみたいで、そのうちつくやろ」と。確かに翌年の夏前にエアコン設置の工事が始まりましたが、各部屋の天井から200kgはあろうかと思われるユニットをつり下げて廊下には潜水艦の天井のようにパイプを張り巡らす工事は、築2年で既に稼働していた研究室の天井に穴を開けたり壁をぶち抜いたり、日本のお役所のやることには度肝を抜かれたことでした。
最初の給料を頂いた時にも当時の公務員研究職の水準には驚きました。果たして親子四人「健康で文化的生活」が営なめるのか、アメリカのポスドクの方がましだったか、と真剣に悩むほどでした。山本先生からは「あんた医者やったら臨床を捨てたらあかんで」と云われ、高脂血症患者の外来診療をお手伝いすることになりました。「研究で飯をくおうか」とも思い始めていたところだったので、このご助言には今に至るも本当に感謝しております。医師免許を持つ医学研究者の最大の利点は「患者を実際に診ることができる」ことにあると思うのですが、この一言がなければそれを認識できないままになっていたかも知れません。
さてスタチンです。当時compactin (ML236B)は三共の手ですでに臨床試験にはいっており、国立循環器病センターや金沢大学ではかなりの数の患者さん(主としてFH)に投与されておりました。まだプラセボ二重盲検試験が標準として定着する前、有史以前の出来事です。ところが2〜3年たつと、どうもcompactin には何か副作用があるらしいということになり治験が止まります。その間にメルクが日本でsimvastatin の試験を開始します。メルクはもともと北米でlovastatinを開発していましたが、遠藤章さんが同じ物質の特許申請をしており、先願の定義の違いで北米以外の地域ではこれに抵触することになってbackup compound のsimvastatin を臨床開発することにしていたのです。結局日本ではsimvastatin が先に上梓され、三共はpravastatin への切り替えにより後れをとることになります。
こうして1988年までの循環器病センターの在職中、私は三つのスタチンを処方することになりました。三共でpravastatin の開発の先頭に立ったのは、のちに日本のCROのパイオニアとしてCMICを立ち上げる中村和男さんでした。彼はこの開発に際して、松沢佑次先生、北徹先生、馬淵宏先生や私など当時の若手研究者を意識的に前面に立て、日本の臨床脂質研究の世界に一石を投じました。

Pravastatin 治験第三相の論文
今にして「さすが」の感をもちます。この間、スタチンの効かない(つまりLDL受容体が発現していない)FHホモ接合体患者の治療法として、体外循環装置を用いて兎も角LDLを血漿から取り除く、究極の対症療法と云えるLDLアフェレーシスの技術の開発にも携わる経験もし、多少中途半端ではありましたが臨床研究者としての経験も積むことが出来ました。
1988年に私はカナダのアルバータ大学の脂質研究グループに職を得て、移ることになりました。その頃、北米ではlovastatinの臨床使用の開始に伴い、血漿脂質の管理による虚血性心疾患の予防が現実の臨床課題となりつつあり、Lipid Clinic という臨床のジャンルが広まり始めていましたので、赴任した早々に「それをやってくれ」と云われます。私はそれまで北米での臨床経験はありませんでしたが、研修医の頃に受験が流行ったアメリカの臨床研修医(レジデント)の資格試験「ECFMG」に合格していましたので、大学からの推薦でカナダの内科専門医のライセンスを得てアルバータ大学でのLipid Clinic を立ち上げることになりました。そして、そこからスタチンの開発ラッシュにつきあうことになります。
まず最初は北米でのメルクのlovastatinからsimvastatin への切り替えです。そのための比較検討二重盲検試験が最初のカナダでの本格的臨床治験の経験でした。そこへ三共からブリストル-マイヤーズ-スクイブにライセンスされたpravastatinの北米での開発やサンドによる最初の全化学合成スタチンであるfluvastatin の開発が始まり、三者三つどもえの市場争奪戦になります。各大学のLipid Clinic 担当者は全米やカナダ各地の「研究会」に引っ張り回され、地元は地元でアルバータ州各地の町の「医師会講演会」に何度も出向くことになりました。この時にスクイブが仕掛けたスタチンの臨床効果や副作用についての「疎水性・親水性論争」があとあとまで世界のスタチン市場争奪戦に尾を引きます。そして、1994年と1996年のsimvastatinとpravastatinの大規模臨床試験による虚血性心疾患の予防効果の確認で、スタチンの臨床的地位は確立されたことになります。
アルバータ大学在職中の最大のイベントはMRC(カナダでのNIHに相当)とメルクの大型グラントによるsimvastatin とenalapril 2 x 2 での冠状動脈退縮の大規模試験 に co-PIとしての参加でした。

アルバータ大学で行ったSCAT Trialに脂質専門家としてCoPIで参加。Circulation 102: 1748-1754, 2000
1990年代初めという歴史的時代に北米で多くの本格的臨床試験を経験したことはいろいろな意味で大変勉強になりました。
それらを追いかけて、1990年代前半には新たなスタチン開発競争が始まります。所謂strong statin時代の始まりです。まず当時ミシガン州にあったワーナーランバートという会社がatorvastatin を開発します。カナダでの初期の「研究会」で会った顔見知りのワーナーの開発者から「日本で”ヤマノウチ”という会社と話をしているが、どういう会社か教えて欲しい」と聞かれたことを覚えています。この後すぐ、ワーナーはアップジョンに買われ、さらにアップジョンはファイザーに吸収されるという騒ぎの果てにatorvastatinはファイザーの持ち駒になって実際に山之内製薬(現アステラス)によって日本で販売されることになります。
同じ時期にドイツのバイエルが cerivastatin の開発を始めており、私はこちらの方の第三相を引き受けていたのでatorvastatin の治験には参加しませんでした。バイエルはこの治験に相当な体制を組み、主要メンバーはカナダの製薬企業の集積地であるモントリオールに何度も集められ周到な議論が重ねられました。かなりの研究費が提示されてプロトコールが示されると「被験者は男女ともに避妊を義務づける」とあります。私がこれは具体的にどう担保するのか、と質問をすると担当者が「考えてみる」と云う返事です。
2〜3週間すると仰天することが起こりました。研究室に大量の「コンドーム」が送られてきたのです。同僚やラボスタッフは大喜びで「Shinji が何の研究を始めるんだ」と騒ぎたてました。ところが、study nurse も雇い治験開始を待つばかりになった時、突然バイエルから「治験の無期延期」が通告されたのです。後で問題になる動物実験における精巣変性のせいだったとも云われています。一旦雇用したnurseをlay off したり患者に謝ったりして、やっと半年後に再開となりました。この時は、幸い治験自身は大過なく終わり、これを見極めて私は再び研究の拠点を日本に移すことになり、1996年に名古屋市立大学に赴任しました。
名古屋に移って間もない1997年、cerivastatin 第三相治験終了の global meeting がフロリダで開催されました。そこでの基調講演でEvan Stainが動物実験での犬の精巣変性を示し、発症や所見に用量依存性がないので大丈夫、という意味のコメントをしました。これに納得がゆかなかった私は、「用量依存性がない」というのは逆にまずいのではないか、発症機序をもっと詰めるべきでは、という意味の質問をしたところ、これが各国での許認可で大問題になったようだ、とあとで聞きました。いずれにせよ、これで日本では武田による販売に至ります。
1996年に名古屋市大に移って暫くしてから、当時の厚生労働省薬務局の審査課から「新薬(審査)第二調査会の委員に」という依頼が舞い込みました。これには、前述した三共を脱サラしてCMICを立ち上げすでに活躍し始めていた中村和男さんの差し金があったと推測しています。それからの数年間、PMDAの発足と許認可業務の審査課からの移管などの我が国の薬剤許認可システムの「国際標準化」の激変期に、脂質領域の新薬の許認可に関わることになりました。Atorvastatin は既に認可済みでしたので、審査課のシステムではfenofibrate、PMDAとなってからは rosuvastatin の審査に関わることになりました。その後、私自身が創薬ベンチャーを起業したことなどから委員を辞任し、pitavastatin の認可には関与しませんでした。この過渡期の混乱の影響で、我が国のの投与用量は海外のほぼ半量となっているstatinの中で、atorvastatin のみが海外と同量になっており、未だに整合性がとれない状態が続いています。その他にも、この時期の影響が残っている事例があるように思います。日本発の大規模臨床試験であったpravastatinによるMEGA Studyを巡る混乱(注)もこの過渡的時代の産物でしたでしょう。
名古屋市大では基礎の教室(生化学)での教育研究が本務だったのですが、内科の教授で脂質代謝研究に熱心に取り組んでおられた藤波隆夫先生に強く勧められ、付属病院で脂質外来を受け持つことになりました。その結果、2014年に名古屋市大を完全に離れ外来を閉じるまで、atorvastatin、cerivastatin、rosuvastatin、pitavastatin の所謂 strong statin の臨床使用にも関わることになりました。この間、fibrate 剤(gemfibrozil)との併用による副作用の出現によりcerivastatin の市場からの撤退というアクシデントにも遭遇しました(gemfibrozilは日本では承認販売されていない薬剤でしたが)。この問題については他に詳しく触れる機会があるかも知れません。
日常としての脂質異常症の治療現場から離れた後も、「年の功」からか、新しい治療技術開発がなされる都度にその最新情報に接する機会に恵まれ、こうして 1981年から今日まで40年以上にわたり脂質異常症治療のいわば最前線を経験し、多くの新規治療の臨床応用にも携わりました。つまり私どもは、近代的脂質異常症の研究と臨床をリアルタイムで経験できた幸せな世代であったと、今更ながら考えます。そのなかで、実際に患者さんに処方されたスタチンは compactinからpitavastatin まで9種類になります。その中で、compactinは日本で短期間治験で処方されたのみで市場に出ることはなかったのに加え、lovastatinは北米のみで処方された後に市場から消え、cerivastatin は世界の市場から撤回されて、新たなスタチンの開発はおそらくもうないでしょう。
さて、そこで思い返してみてある日気がつきました。私はこれらのスタチンの全てを実際に患者さんに処方したことがあるのです。これらが処方されていたタイミングと場所(つまり日本と北米での臨床経験のタイミング)から考えて、これらのすべてのスタチンについて臨床現場で実際に処方経験のある医者は、おそらく世界でただ一人、私しかいないのではないか、と。大げさに言えばとんだ「歴史の証人」となったわけです。たいした研究業績も残せなかった私としては、これだけは「自慢しておきたい」履歴かも知れません。
5. ステロールの迷路
「初めての論文」から50年近く、すっかりすれっからしの老人になってしまいましたが、結局「生命にとってステロールとは何か」という問にはなにも答えられないままになってしまいました。勿論、この50年の間に、それが具体的に何をしているのか、そのために生命体はどんな仕組みをつくってきたのか、そういう具体的な「知見・知識」は積み上がり、私たちの理解は大きく進みましたし、私自身もそれには多少の貢献はしたのかも知れません。ステロールを必要とする境界線は、前核生物から真核生物、単細胞生物から多細胞生物の間あたりにあります。しかし、前核生物の一部、真核で単細胞生物の一部はステロールを必要とするので、この前引きは厳密なものとは云えませんが、卵生の哺乳動物もいるようなものかも知れません。真菌はergosterol、植物は plant sterols、動物は cholesterolと厳密な「使い分け」はありますが、いずれもラフト形成がその鍵であろう事は推測でき、多細胞生物での細胞間での情報のやり取りが基本的機能と考えられますが、単細胞の真菌類では芽胞形成にそれが要求されるようではあります。
実際、スタチンは最初抗真菌剤として発見報告され、遠藤さんによるステロール合成阻害効果の報告は二番手でした。なぜ生命はこのような「変な」分子を発見し利用するようになったでしょう。生合成には大変な手間暇がかかり、薬剤や液晶などの多くの工業用にはいまだに化学合成は割が合わずすべて生物材料が原料とされます。異化分解もままならなず、基本骨格の分解はバクテリアに外注アウトソーシングですませています。長い生命の進化の歴史のなかで、ステロール分子がどの段階でどういういきさつで生命体に利用されるに至ったのか、その起源は何なのか。Acetyl-CoA から生合成が始まるのはエネルギー代謝からの派生なのか膜の形成の進化の一環なのか。誰かご存じの方、あるいはご意見をお持ちの方、是非お聞かせいただきたいと思います。
もう一つ分からないのはLDL受容体です。最初に述べたように、LDL受容体の発見は脂質研究にパラダイムシフトを起こし、その後のステロールを始めとするこの分野の研究は細胞生物学的分子生物学的考え方へと大きな方向転換が起こりました。しかし、一連のSturm und Drang の時代が落ち着いてきた今、LDL受容体とは何なのか、と考えざるを得ません。
まず、この「受容体」が発見されて以後、沢山の関連類似の膜蛋白とその遺伝子が同定され、LDL受容体family と呼ばれるようになります。そしてそれぞれが特異的リポタンパク質に対する選択的受容体である、と理解しようとする研究が沢山行われました。なかんずく、VLDLやchylomicronが「中途半端に」代謝された「レムナント粒子」ないし「intermediate density lipoprotein; IDL」の受容体であるとする実験成績が数多く示されました。しかし現在に至るもこの概念は確定されるには至っていません。唯一確実にリポタンパク質代謝に関わっていると信ずるに足るものは、鳥類の卵細胞に発現している「VLDL受容体」です。この発現のない変異体では卵黄の形成が起こらず、受精卵は孵化しませんし、血漿中にVLDLが大量に滞留して動脈硬化を起こします(私のアルバータ大学時代の同僚で後にウィーン大学教授になったWolfgang Schneider の仕事です)。しかし、例えば中枢神経系で発現するこのfamily に属する「受容体」には、明らかに脳の発生・形成に必要な情報伝達系を担うと考えられるものも多く、リポタンパク質代謝に関わる受容体とは考えられません。つまり、LDL受容体 family とはもともと情報伝達を行う受容体のグループであり、その中のごく少数が脂質代謝に特化した進化を遂げたと考えるべきなのでしょう。
LDL受容体が血漿LDLの代謝に決定的に重要な役割を演じているのは、その機能不全である FH が血漿中へのLDLの滞留を招き若年性動脈硬化を起こすことから、疑いの余地はありません。血漿LDL濃度は(おそらく主として肝臓の)LDL受容体の活性で制御されています。食餌性コレステロールの過剰な摂取は肝臓のLDL受容体活性を抑制し血漿LDL濃度の上昇に繋がり、摂取の抑制や吸収阻害は逆にLDL受容体活性上昇とLDL濃度の低下をもたらします。ところが、コレステロール摂取を殆どゼロにしてもLDLはある程度以上には下がらず、おそらく肝臓におけるコレステロールの生合成による補填がLDL受容体活性の上昇にも抑制的に働いていると考えられます(これは若き日の北徹さんの永平寺の修行僧の血漿リポタンパク質を調べた素晴らしいお仕事です)。つまり、我々の血漿LDL濃度は摂取不足には対応できるが過剰摂取には対応できない制御システムなのです。我が遺伝子の進化段階は過栄養状態は危機管理の想定外、ということになります。
これだけ分かりやすい制御システムによるLDLによるコレステロール供給は我々の細胞にとって決定的に重要かというと、どうも全然そうではなさそうです。というのは、LDL受容体のないFHホモ接合体患者でおこる「病状」は、血中に滞留したLDLによる動脈硬化(あるいは黄色腫など)であって、その他にはなにも健康被害はないようなのです。身体的精神的発達にも全く問題は認められません。つまり、LDLによる細胞へのコレステロール供給システムは、動物生命にとって「無用の長物」なのではないか、ということになります。細胞によるグルコースの利用の障害である糖尿病では(おそらく細胞のエネルギー源不足による)様々な細胞の障害に基づく多彩な合併症を起こすのと好対照です。進化のある段階でどうしても必要だったLDLによる細胞へのコレステロール供給システムがある時期から無用の長物となり、システム障害が健康被害をおこすだけという存在になってしまっているとは考えられないでしょうか。
こうした疑問を解決するには、私はもう時間切れです。どなたか、この問題を引き継いで、解決にエネルギーと時間を割いて下さる若い研究者が出てきていただくことを切に願う次第です。
謝辞
こんな雑文に謝辞もないのですが、私の半端な研究暮らしのなかで、多くの方々にお教えを受け、また若い方々に助けていただきました。その全ての御名前を挙げる事は出来ませんが、皆さんにこころより感謝しております。中でも、東京大学の当時の第三内科で研究の最初の手ほどきをしていただき世の中に送り出していただいた赤沼安夫先生、シカゴ大学でポスドク研究のメンターであり私の科学的思考の全てをたたき込んで下さった Ferenc J. Kézdy 教授、私を脂質異常症の臨床につなぎ止め臨床研究への情熱を身を以て示して下さった国立循環器病センターの山本章先生、には最大限の謝意を表させていただきます。コロナパンデミックの直前に亡くなられた山本先生とKézdy先生のご冥福をお祈りいたします。
(この稿の一部には、日本動脈硬化学会五十周年記念誌に掲載されたもに加筆訂正編集を加えたものが含まれています)
2022年12⽉28⽇
北里環境科学センター名誉顧問 伊藤俊洋

はじめに
現在の地球は、新型コロナウイルス感染症(COVID-19)による空前のパンデミックの中で、ロシアによるウクライナへの侵攻により第三次世界大戦の危機にも瀕している。核兵器の使用も取りざたされる中で、ウクライナの一般市民が爆撃に晒される惨状を目の当たりにしながら、なす術もなく立ちすくんでいる。経済制裁は両陣営に絶大な犠牲を強いることになり、その被害は常に弱者に強く波及する。なんと無益な所業なのだろうか。
この度の新型コロナによるパンデミックは、人類が築いて来た文明の脆弱さを、白日のもとに晒している。ウイルスにとって、国境は何の意味も持たない。自国第一主義を掲げていては、世界的なコロナ禍を脱却することはできない。人類は、誕生以来、多種類のウイルスと接してきた。それらが病の原因となることも多々あるが、ヒトのゲノム(全遺伝情報)の約半分はウイルス由来と考えられている。変異株を含むSARS-CoV–2について分かったことを検証し、人智を尽くして対策を立て、全ての人が他者を思いやる冷静な行動をとることで、このパンデミックを乗り超えられるだろう。
この未曾有のパンデミックと戦争を体験している人類には、遺伝情報と環境要因を包括した生命観に基づく新しい哲学が必要なのではないだろうか。その哲学は、子供から老人まで全ての世代の人たち、また、全ての国の人たちが容易に理解できる普遍的なものでなくてはならない。私は、北里大学の教員の時期(1964年〜2007年)に、新入生に対する一般化学の講義の中で、科学全般の入門的な話をしてきた。それは、その後、「宇宙生命哲学」という新しい哲学の提唱へと発展した。
宇宙生命哲学は、地球上に現存する生物の一員である人類の一人一人が、宇宙における立ち位置と役割を踏まえ、尊厳を持って生きるための哲学である。今回は、この哲学を紹介しながら、これからのポストコロナの時代を生き抜く人類のあり方について私見を述べたい。
文明の起源は記録を残すこと
人類(ホモ・サピエンス)は、生活を豊かにするために、様々な情報交換の方法を編み出して来たが、およそ1万年ほど前に、考えたことや体験などの情報を文字という記録手段で後世に残す方法を開発した。一旦、それらの情報が記録に残ると、その後に生まれた人類は、蓄積された情報を踏み台にしてその先を考えることができる。
情報の蓄積は増幅し、人類共有の巨大な知的財産となり、社会で広く利用されるようになった。地球上には多くの民族や国家が誕生し、それぞれが情報を交換しながら独自の文明や文化を創出してきた。
文明相互の交流により知識の裾野は広がり、その上にそびえる科学的知識は進化を重ね、人類は、アッという間に月を往復できるまでの科学的知識を獲得したのである。38億年という生命の歴史の中で、情報を共有する形で記録に残したのは、人類だけである。人類の文明の起源は、情報を記録するという行為であると断言しても良いと思う。蓄積した科学的知識は、人類共有の財産と考えるべきである。
循環している地球上の生命は地球環境のパラサイトである
地球上の生命現象を俯瞰的に眺めてみよう。宇宙から地球を観れば、地球が、水の惑星、生命の惑星であることが容易に理解される。現在の科学的知識に基づくと、地球上のほとんどの生物は、植物や藻類などの光合成で作られた糖類などの栄養素を利用して生きている。光合成とは、植物などが光によって水を分解し、酸素を発生させ、二酸化炭素を糖などの有機物に変換するシステムである。
動物は、植物と違い、光合成能力を持っていないので、無機化合物(水や二酸化炭素)から、糖などの有機化合物を作ることはできない。動物は、植物などが作った栄養素を利用して生育し、動物どうしの食物連鎖により栄養素の移動が行われる。
人間は、これらの食物連鎖の頂点に立って、地球上の広範囲の生物を食料源にして生活している。一方、地球上のすべての生物は、死ぬと様々な化学反応によって、単純な化学物質(二酸化炭素、水、ミネラルなど)に変換され、環境に還ってゆく。発生した二酸化炭素は大気の中に無限に拡散してゆく。ミネラルも水に溶けて、大地と海洋を循環する。つまり、人類を含む全ての生物は地球環境から生まれて来て、死ぬと地球環境に還って行き、地球環境のパラサイトとして循環しているといえよう(図1)。
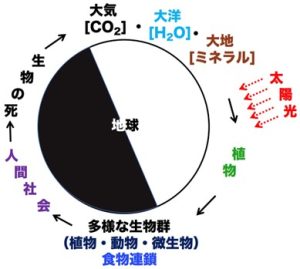
図 1 :地球上の生命の循環
地球は時空を超えた高次元巨大環境生命体である
地球上の生命現象とは、太陽エネルギーを基盤にして、水と二酸化炭素とミネラル群が織りなす壮大な物質循環の世界と捉えることができる。生命現象は、原子論的には、化学反応として表現できる。化学反応とは、複数の原子の電子雲の間で起こる電子のエネルギー準位の変化として説明できる。
電子雲の体積は、原子核に比べて1兆〜千兆倍も大きいが、その領域でめまぐるしく動いている電子の大きさと数を考えると、この電子雲は、大きな空間とみなされる。その存在が、多種多様な化学反応を引き起こす所以である。
この電子雲の中の電子の挙動は、およそ100年前に発見された量子力学という新しい学問で解明されつつあり、電子雲の中には、生命科学を始めとする科学技術の限りない可能性が隠されている。換言すれば、将来の人類社会には、大いなるフロンティア(開拓の可能性)が約束されているといえよう。
「我々は何処から来たのか、我々は何者か、我々はどこへゆくのか?」の問いに対しては、「我々は環境から生まれ、環境に戻る。我々は、時空を超えて、地球上の全ての生物の中を循環している。」と答えることができる(図2)。生物の死とは、絶望的な奈落の淵に落ちて行くことではなく、この地球上で、常に新しく環境の一部として生まれ変わることである。これは、紛れもない科学的な事実である。

図2:「我々はどこから来たのか 我々は何者か 我々はどこへ行くのか」(ポール・ゴーギャン/1897年)
このことを宇宙的視野でまとめると、地球上の生命世界は、人類をはじめとする全ての動物、植物、微生物、さらには大気、大地、大洋の環境を含めて、時空を超えた高次元巨大環境生命体(宇宙船地球号)と考えることができる。
46億年前に太陽系が誕生してから、地球上では8億年の化学進化の時代があり、その間に、生命の基になるアミノ酸・糖・脂質・塩基といった化学物質が作られ、38億年前に、地球上に奇跡の生命が誕生した。その生命の誕生の謎は、まだ科学的に解明されていない。この課題は、人類が科学的に解明しなければならない最大の謎の一つである。
生命が誕生したこと自体、奇跡のように重大な出来事であったが、それに勝るとも劣らない出来事は、地球環境が、生命を育み継続して子孫を増やせる豊穣な環境になったことである。地球環境は、長い産みの苦しみの後、新しい生命を誕生させ、様々な環境変化に耐え、豊かな生命世界を構築して、現在の生物多様性に彩られた巨大環境生命体となった。巨大環境生命体の誕生を、地球環境に生命が芽生えた時とするならば、その年齢は、38億歳ということになる。
巨大環境生命体は、38億年という長い年月を生き抜いて、今、宇宙空間に青い惑星となって浮かんでいる(図3)。

図3:生命の惑星, アポロから見た地球の出(“Earthrise” by Bill Anders from the Apollo spacecraft, Dec. 24, 1968)
巨大環境生命体の頭脳としての人類の文明と学問の階層性
この巨大環境生命体の頭脳はどのようなものだろうか。人類は、およそ1万年前に文字を発明し、文明を誕生させて、膨大な量の科学的知識を獲得した。この科学的知識は、物理学、化学、生物学、心理学という基幹学問の相互関係を整理することにより、図4に示す学問の階層性という概念で表現することができる1)。
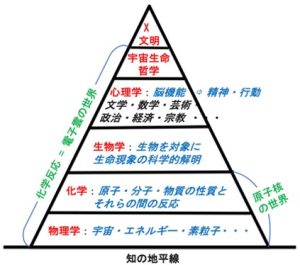
図4 学問の階層性
これを要約すると、心理学は生物学によって支えられ、生物学は化学によって支えられ、化学は物理学によって支えられている。これは、近年、著しく細分化し、また先鋭化ている学問領域を、俯瞰的に、また系統的に理解するための方策の一つである。この概念の中で、最も重要な考え方は、形而上学に代表される精神活動も含めて全ての生命現象は、最終的に物理法則で説明されるということである。
人の精神が関与する領域、例えば文学・数学・芸術・宗教・信仰・喜怒哀楽なども、最終的には化学反応として説明される筈である。現在、多くの生命現象が化学反応として説明できていないのは、科学が未成熟のためである。逆に言えば、人類の未来には多くの可能性が残されていると言って良い。
巨大環境生命体の頭脳は、この学問の階層性として纏めた情報ネットワークと考えて良いだろう。このネットワークは、過去のすべての人類の努力の賜物であり、現在も凄まじい勢いで成長しつつある。図の中で宇宙生命哲学を心理学の上に位置付たのは、この哲学が、物理学、化学、生物学、心理学という基幹学問の中心軸として、文明社会に対する指針の役割を担っていると考えたからである。ピラミッドの先端に位置するX文明は、まさにこれからのポストコロナの世の中で人類が目指すべき文明である。全ての人類は、宇宙生命哲学の理念に則り、新しい文明世界を切り開いて行く絶好の機会に遭遇していると考えたい。
全ての生物の頂点に立っている人類は、生物の代表者として、この宇宙船の羅針盤の役割を担っている。特に、科学、教育、政治、経済、宗教に関わる人たちは、この学問の階層性について、深く理解して欲しい。
素敵な地球人になる終わりのない練習
このような立場にある人類は、どのように人生を送ったら良いのだろうか。人間の一生は、素敵な地球人になる終わりのない練習を続けていると考えよう。素敵な地球人の定義は、人それぞれで違っていて良いと思う。人生は、それぞれの人が、自分の目指す素敵な地球人像を、生涯かけて探し続けることではないか。急がず、休まず、ゆっくりと、着実に、一歩、一歩、自分のペースで人生を刻んでゆく。その過程で、人と交流し、学び、互いに助け合いながら、自分の人生を思う存分に楽しむことができるだろう。練習だから失敗も許される。失敗しても、失敗しても、再挑戦が許される。この哲学の、最大の特徴の1つである。
さて、素敵な地球人になるための心得を列記してみよう。
常に、宇宙から地球を観る感覚で思索する。物事を、科学的に考える。原子論に基づいて考える。生命にとって最も大切なものは地球環境であると考える。地球が自分の家だと思って思索し、行動する。現在の生活基盤は、過去の人類の努力の賜物であると考える。世界の人たちと連帯することを考える。苦労することを厭わない。利他の精神を大切にする。欲張らない。そこそこの生活に幸せを見つける習慣をつける。仕事で得られた富は、地球人のために使うようにする。日常生活の中で、仕事、家庭、趣味、社会奉仕活動を大切にする。
現時点で、私は、次のような人を「素敵な地球人」だと考えている。
素敵な地球人は、国家・人種・民族・宗教・性別・貧富の差・文化・文明の壁を越えて仲良くし、あらゆる人権を尊重し、民族の多様性、生物の多様性を尊重し、あらゆる生物を大切にする。戦争をしない、むやみに水や空気や土壌を汚さない、生活を楽しむ、そして、自分の心の宇宙を、広く、深く、豊かなものにする努力を死ぬまで続ける人である。
この度のコロナ禍で、またウクライナで、多くの素敵な地球人が、志半ばでこの世を去った。過酷な医療現場で病魔に襲われ、壮絶な人生を全された医療従事者も数知れない。残されたご遺族や友人の心の中に、その神々しい姿が末長く生き続けて、残りの人生を生き抜くための限りない力となることを願っている。そして、我々は、地球環境の中で循環していることを、身を持って感じ取ることができる。
世界が注目した東京五輪2020と北京冬季五輪2022の開会式で、ヨーコとジョンの「イマジン」が世界を一つに結んだ。資本主義社会と社会主義社会が目指しているところが、奇しくも同じであることが証明された出来事であった。「宇宙生命哲学」の精神にも繋がっている。
想像してごらん / 天国も地獄もない / 国も宗教もない / 飢えや争いごともなく / みんな一つの世界で / 一緒に生きている / 夢じゃないよ / みんながその気になれば / すぐ実現する
私も、本当に、そう思っている。今、地球上で戦争に突き進んでいる指導者たちに、心からこのメッセージを届けたい。
2022年05⽉03⽇
東京大学名誉教授 脊山洋右

1.プロローグ:むく鳥と横須賀線電車、朝の出会い
私は毎週、月・金・土曜日に東京都文京区の白山にある自宅から次男の脊山英徳が2015年に開院した逗子脳神経外科クリニックに通って、認知度の検査という診療を担当しております。新型コロナの感染が広がった2020年の3月からは感染防止のために往復140キロを自らボルボを運転して通っておりましたが、2021年7月に東京オリンピックが始まったのを機会に横須賀線電車による通勤に切り替えました。私が乗車する6時44分発の電車は東京駅始発なので感染の危険が少なく快適な乗り物です。
この電車が新川崎駅を発車して数分後の7時11分に、左側の車窓に60羽から成るむく鳥の群れが高速で飛翔するのに気が付いたのは8月末のことでした。電車も時速100kmで走っていますので、それは一瞬の出来事でした。
その後何回か目撃しているうちに、むく鳥が偶然に横須賀線の電車と出会うのではなくて、群れが毎朝同じ時間に同じルートを飛んでいると考えるようになりました。
この出会いはその後9月、10月と月日が進んでも続き、年が明けた2022年の3月になっても見られましたので、むく鳥が同じ時間に同じ行動をするのには深い訳があると考えるようになりました。
2.むく鳥の群れにはリーダーがいる
私は10月にスマホをiPhone13 Pro Maxに機種変更しましたが、このスマホに備わった写真機能は大変優れていて、新川崎を出た直後からビデオ撮影したところむく鳥の飛翔を鮮明にビデオ録画することに成功しました。その1画面を見ると群れは60羽近くからなり、先頭を飛ぶリーダーとその直後の両側に位置するサブリーダーが存在することが分かりました。また雄と雌の2羽が対になっているものも何組かおります(図1)。
 図1 横須賀線の車窓から目撃したむく鳥の群れ
図1 横須賀線の車窓から目撃したむく鳥の群れ
3.むく鳥の飛翔は体内時計だけでは成しえない
動物の体内の現象は代謝をはじめ時間によって異なりますが、この現象の時間を規定しているのは体内時計であり、今ではその遺伝子配列や視床下部における発現機構も明らかになっております。
むく鳥も体内時計によって飛翔行動をしていることは容易に察しられますが、電車の窓から目撃した群れとしての行動の裏には位置情報を察知する「GPS機能」というものがあって、これが体内時計と連動して私が目撃した朝の飛翔行動になったのではないかという考えが浮かびました。
4.体内時計とGPS機能は太陽によって規定される
ところで、この体内時計の1日周期は24時間11分であって地球の自転よりも11分ほど長いと言われております。このずれを調節して24時間にしているのは太陽の動きを感知することなのです。ネットで検索するとこれは「朝、太陽の光を浴びることだ」と書かれていることが多いのですが、正しくは「日の出の太陽」にではなくて「正午の太陽」に合わせるのだということがわかりました。
私がむく鳥と出会う新川崎の日の出は9月1日には午前5時14分、1月1日には午前6時51分、4月1日には午前5時29分というように1日に2分ずれていきますが、それに対して正午は常に午前12時00分で不変なのです。日の出はその方角も毎日ずれていきますが、正午には太陽が常に真南に位置しております。この正午の太陽を基準にして体内時計は24時間00分に調節されているのです。
この体内時計だけではむく鳥の行動を規定することはできません。身体の位置情報を管理する「GPS機能」も正午の太陽の情報を検知して、南という方角とその高さからむく鳥は自分の位置を認知していると思います。
時計遺伝子としては既に2群の時計転写遺伝子と2群の時計抑制遺伝子が知られておりますが、今回注目した「GPS機能」も位置遺伝子があって、これも正午の太陽によって調節されていると思いますが、これは今後の研究対象となります。
5.むく鳥の顔認証
体内時計と「GPS機能」を結びつける研究対象として毎朝決まった時間に同じような飛翔をするむく鳥は最適かと思いますが、そのためにはむく鳥の個別認証が必要となります。近年の画像解析の技術には優れたものがあり、私が手にした5G対応のスマホでも高速で動く物どうしの行動観察ができます。ただ、リーダーの識別や番いになって飛ぶむく鳥を個別に識別するためにはヒトで培われた顔認証の技術を応用してむく鳥を個々に追跡する必要があります。
私は以前、ゴールデンハムスターの眼窩にあるハーダー腺が分泌するアルキルジアシルグリセロールの研究をしておりました。この分泌脂質は雄では直鎖の脂肪酸しか含まれておりませんが、雌ではiso型とanteiso型の分枝鎖脂肪酸が多量に含まれているという雌雄差があります1,2)。そこで当時、この脂質はフェロモン機能を持っているのではないかという仮説を立てたのですが(図2)、それを実証する為にはゴールデンハムスターを長時間にわたって個別に行動観察する必要があります。
 図2 ハーダー腺脂質の機能
図2 ハーダー腺脂質の機能
その当時に顔認証ができていれば、AIを用いた動画の画像解析で行動観察する実験計画を立案してフェロモン説を実証できたのではないかと悔やまれます。
1) Seyama,Y., Hida,A., Hayashi,S., and Buzzell,G.R. : J.Biochem., 119, 799-804 (1996)
2) Hida,A., Uchijima,Y., and Seyama,Y. : J.Biochem., 124, 648-653 (1998)
6.横須賀線は2022年3月にダイヤ改正
2022年3月12日に横須賀線のダイヤ改正が行われ、私が乗っていた6時44分東京駅始発の電車が平日はこれまで通りですが、土曜日だけは6時48分発に変わりました。
その結果、月曜、金曜は相変わらずむく鳥の飛翔と出会いますが、新川崎通過が4分遅くなった土曜日には見かけなくなり、むく鳥の体内時計の正確さを実感した次第です。
7.エピローグ:文献検索の大切さ
むく鳥と横須賀線電車との出会いから体内時計とGPS機能の繋がりにまで話が弾みましたが、それに関わる個々の事柄は既に研究されていることが多く、現在ではネットでの情報検索が容易になったお陰で、瞬時に関連する既知の文献を調べられるようになりました。
私は2010年から医学中央雑誌刊行会に理事長として関わっております。1903年に創刊された「医学中央雑誌」は2000年からは医中誌Web (https://search.jamas.or.jp)(図3)としてオンラインでのデータベースとなり、現在では14,774,131件の文献情報を提供しております。
 図3 医中誌Web
図3 医中誌Web
これは国内で発表された文献が中心ですが、最近ではPubMedにもリンクされておりますので、日本語のキーワードを入力して世界の文献を検索することもできます。
体内時計に関する研究は多くの観点から行われて様々なことが明らかになっておりますが、今回取り上げたGPSに関わる位置遺伝子というキーワードでは該当ゼロという検索結果になりました。このことは身体の位置情報をつかさどりGPSとしての機能を果たしている遺伝子は未知の領域にあるという意味であり、今後の研究が待たれます。
ここに述べたような自然の観察から何か新しいアイデアが浮かんだ折には、是非とも医中誌Webで検索して研究を進めて頂きたいと思います。
若い会員の活躍を期待する脂質生化学を学んだ先輩からのメッセージです。
2022年01⽉04⽇
北海道大学招聘客員教授、名誉教授 五十嵐靖之

10月に敬愛する梅田眞郷先生より,新しく脂質生化学会のホームページを立ち上げて,そのなかに「脂質の窓」というコーナーを設けたのでぜひ書いてほしいという執筆の依頼を受けた。何を書くの?「なんでもいい、先生のやっている短歌やパンセのブログでもいいですよ」と言われ気が少し楽になり、やっと書いてみる気になった。あまりきちんとしたものでなく、まあ「つぶやき」みたいなものでよいということと理解した。ただし「きれい」とか「うまい」とかつぶやくだけではなく少しは意味のありそうな脂質、あるいは脂質研究に関連した「つぶやき」が求められているようだ。愚痴や不満、あるいは希望、期待でも、かけ声でもよさそうだ。
世の中では終活という活動が盛んらしいが,自分は今、来年春で研究室を閉じる研究終活のさなかにある。日本、アメリカ、そして北大での正規教授として続けてきた脂質研究を、更に13年間、特任教授,その後招聘客員教授として研究室を引き継ぎ、この間スフィンゴ脂質の基礎的研究から最近の創薬,機能性食品開発の応用研究を続けてきたが、来年喜寿を迎えいよいよ終りにすることにした。そしてこの7年間、研究室での最後の研究活動、研究管理と並行しながら、AMED—CREST/PRIMEの「画期的医薬品等の創出を目指す脂質の生理活性と機能の解明」という2015年から8年間続くプロジェクト(AMED脂質)の研究副統括として統括の横山信治先生とともに務めさせていただいた。この間自分達より遥かに若いしかも優れた研究者達の広い分野の研究に、老骨、いや、いや老脳にむち打って、アップアップではあったが真剣に向き合うことができ、個人としても極めて貴重な経験を積ませていただいた。研究の終活を迎えようとしている一老研究者には思いの外刺激的でしかも楽しい時間でもあった。
さて、CRESTの13課題は,それぞれに脂質の研究の実績に基づいてそれを更に発展させようとする課題で、マスイメージング、一分子観察など脂質分子を直接のターゲットにしているもの,リン脂質や酸化リン脂質、スフィンゴ脂質、糖脂質の生理作用や、生理活性脂質の受容体や脂質トランスポーターや脂質輸送蛋白の機能解明を目指し、それらを様々な病態の解明とその治療法に近づける基盤研究が主で、多くの優れた成果を生み出すことができたと考えている。一方、若手研究者が個人で行うPRIMEもそれぞれ将来の発展につながる優れた成果が得られた。その28課題をとってみると、約半数は脂質研究の外からの応募であり臨床を含めて脂質研究に新しい風を入れようとする研究課題が多かった。これらの採用研究課題で一つ感じたことがある。それはかなりの数の研究がじつは脂質を直に扱っているのではなく脂質に関連した分子、遺伝子、タンパク質を解析対象にしたものが圧倒的に多いのに気づく。それは脂質代謝酵素であったり、脂質の結合蛋白や受容体であったり、またその役割を明らかにするのに遺伝子を壊したり導入したりする実験手法をとることが多いので、むしろ当然のことともいえる。またイン・シリコのデータ取得をめざすものもある。そうした新しい技術導入によって脂質研究が進化してきた訳だし、他分野の研究と脂質研究の融合を目指し、脂質研究を広げていく推進力をもたらしているのも確かだ。まして今回のAMED脂質の目標が「画期的医薬品等の創出を目指す」となっていたので尚更でもあろう。
ただ、ここで一つだけ老人の冷や水的な「つぶやき」を許してもらいたい。もちろん今回AMEDで採択された若手研究者に限ったことではなくて、全体として若手研究者の脂質研究で、一度も脂質という分子に触れずに研究が進んでいく仕事が増えていることである。つまり脂質を直にいじらない脂質研究である。脂質の土の匂いがしない。長い間、脂質は泥臭い研究と言われて自分もそう思ってきたが、今の研究はその土の匂いがほとんどしない研究になってきているものが多い。これでいいのだろうかと、それに何かしらもの足らなさを感じてしまうのは、やはり老研究者の時代遅れの「ぼやき」であるかもしれない。しかし、よくよく考えてみると、脂質研究の出発点には、脂質の他の生命分子、核酸や蛋白、糖とは違ってどんな物性、特性のために生命現象に不可欠なのか、その果たしている独自の役割はなんなのかを絶えず見据えて、そして、それを理解するために一つ一つの性質を異にする脂質分子やそのドメイン集合体が、どんな顔や姿をしていて、どんな性格や癖を持っているのかを、脂質分子を直に捕まえて、いじったり、なめたり噛んだり,観察したりしながら肌を通して付き合うことが根本になければ分からないことがあるのではないか、脂質研究の「泥臭さ」がその真骨頂として大切なはずである。そうした視点が現在の脂質研究に薄れつつあるではと気になるのだ。
若い時の自分自身の脂質研究へのきっかけを振り返ってみても、脂質に関する素朴な疑問が契機となって、それに興味を抱き研究が始まっているのに気がつくことがある。そういうことが出来たおおらかな時代だったと言えないこともないが。一つはHanahanの法則、リン脂質の脂肪酸の一位が飽和で2位が不飽和であるということの不思議さに取り付かれたことがある。なぜ逆だったり同じだったりしないのであろうか?核酸塩基のA=T、G=CとなっているというChargaffの法則に基づいて生物学の革命をもたらしたワトソン・クリックの二重螺旋の発見に繋がったように、そこに目に見えない生体膜における脂質の織りなす微細構造に必要な何かがあるのでは?その幻想にはっきりした答えはもちろん見つかっていない。ただ、その頃脂質研究を始めたばかりの自分が当時Hokin先生の提唱したPI代謝回転という現象に興味を抱きとびついたのも、その疑問が出発点なっていたと思う。それはやがて、PI(PIP2)代謝回転で作られたDGの2位のアラキドン酸代謝や分解産物による脂質情報伝達機構に興味を抱き、やがてアメリカに渡ってスフィンゴ脂質の分解代謝産物であるS1Pの生理活性の研究、帰国後のS1Pシグナリング機構やセラミドの機能研究、更にスフィンゴ脂質やコレステロールの局在する膜ドメインの研究につながっていったと言える。
脂質研究の初期にもう一つとらわれたことがあった。アドレン酸と命名された脂肪酸(C22:4)が副腎皮質(Adrenal Cortex)になぜ極端に多く存在しているのか?なぜたくさんあるリン脂質脂肪酸のある種のものだけがある組織、部位に局在している理由は何なのか?偶然?その分子はもしかしたら副腎皮質のステロイドホルモン合成に関わっているのだろうか?1980年代、まだ質量分析法が確立していない時代にガスクロマトグラフィー法で刺激後の含量の変化を調べた研究をして数編の論文を発表したりした。20:4ではなく22:4からやはりプロスタグランジン様の活性分子が作られるのではないかなど、いろいろ考えたが、ポスドクの立場でその追求は実現しなかった。現在、研究室では自分の最後の仕事として植物由来のスフィンゴ糖脂質の皮膚機能増進や認知症予防効果の仕事に携わっているが、その研究過程でラボの研究員の三上大輔博士が、植物に特徴的なスフィンガジエニンが体内吸収後、S1Pリアーゼの作用でC16:1,n-10(サピエン酸)に変換されることを見つけた。人(ホモ・サピエンス)にしかその存在が知られていないからサピエン酸と名付けられているのだが、この分子がなぜ植物スフィンゴ糖脂質の吸収によって動物で作られ、何の役割を果たしているのかを考えるとワクワクしてくる。なにかあるに違いないと。しかしそれに取り組む時間がもう自分には残されていないし、それは後進の若い人に期待したい。
昨年亡くなられた私の恩師である箱守仙一郎先生は「真の研究のオリジナリティとは、誰もが顧みない課題にとりくんで皆を振り向かせせること」だと常日頃言われていた。自分自身が考え、見つけた現象やものを大切にし、時代の流行や研究資金のとりやすさだけを追ってはいけないという戒めだったと思う。もしもう一度初心に還って脂質研究ができたら、あたりまえすぎて誰もが考えつかなかったような、しかも根源的ともいえる課題を見つけて「泥臭い」研究に取り組んでみたいと思うのだが、ああ残念、時間切れ。これもやはり若い人々に期待するしか道はなさそうだ。